Εισαγωγή: Ο συνδυασμός ηπατοκυτταρικού καρκινώματος και χολάγγειοκαρκινωματος αποτελεί μια σπάνια πρωτοπαθή νεοπλασία του ήπατος με ιστολογικά και απεικονιστικά ευρήματα συμβατά και με τις δύο κλινικές οντότητες, γνωστή και ως πρωτοπαθής νεοπλασία ήπατος με διφαινοτυπική διαφοροποίηση ή ηπατοχολάγγειοκαρκινωμα. Η πρόγνωση της νόσου είναι χειρότερη από αυτή του ηπατοκυτταρικού καρκινώματος και παρόμοια με αυτή του χολαγγειοκαρκινώματος. Η αντιμετώπιση γίνεται σύμφωνα με τις οδηγίες για την αντιμετώπιση του χολάγγειοκαρκινώματος.
Μέθοδοι: Άνδρας 63 ετών με χειρουργηθείσα εξεργασία ήπατος (αριστερά ηπατεκτομή) τον 04/2019, από την ιστολογική του χειρουργείου διαπιστώθηκε μεικτό χολαγγειοκαρκίνωμα χαμηλής διαφοροποίησης και ηπατοκυτταρικό καρκίνωμα σταδίου ΙVa (T2a,N1M0 κατά ΤΝΜ), επί εδάφους γνωστής HCV κίρρωσης (MELD-score:7, child-pugh: class A)- χρήσης ενδοφλέβιων ναρκωτικών ουσιών. Σε μετεγχειρητική σταδιοποίηση διαπιστώθηκε υποτροπή με λεμφαδένα 3.3εκ σε επαφή με τον τοξοειδή σύνδεσμο, 2.5εκ λεμφαδένα αριστερά υποκλειδίως καθώς και δύο εστίες 0.6εκ στο τμήμα VII (lirads 4) και 1.3εκ στο τμήμα VIII του ήπατος. Έλαβε δύο γραμμές συστηματικής χημειοθεραπείας (σχήματα: gemcitabine- cisplatin, FOLFIRI) για διάστημα 22μηνών και 8 μηνών αντιστοίχως. Χορηγήθηκε ένας κύκλος ανοσοθεραπείας με το σχήμα atezolizumab/ bevacizumab και ακολούθως ο ασθενής παρουσίασε σημαντική λευκωματουρία (10,750γρ/24ώρο)- νεφρωσικό σύνδρομο. Ιστολογικά τέθηκε η διάγνωση της μεσαγγειοϋπερπλαστικής σπειραματονεφρίτιδας. Ο ασθενής τελικώς εντάχθηκε σε συνεδρίες τεχνητού νεφρού. Στη συνέχεια, έλαβε το σχήμα durvalumab- gemcitabine για έξι μήνες όποτε σημειώθηκε πρόοδος της νόσου.
Σκοποί: Μετά την αποτυχία της θεραπείας με σχήματα με βάση τη gemcitabine και fluoracil, κλινικές μελέτες συνιστούν την έναρξη θεραπείας με regorafenib 160mg per os. Kύριες ανεπιθύμητες ενέργειες του regorafenib είναι η εμφάνιση υπερτασικών αιχμών, δερματολογικών εξανθημάτων και ηλεκτρολυτικών διαταραχών. Δεν συνίσταται τροποποίηση της δόσης για ασθενείς με eGFR >15 mL/min/1,73m2, ενώ για ασθενείς με eGFR <15 mL/min/1,73m2 ή σε αιμοκάθαρση δεν υπάρχουν αρκετά κλινικά δεδομένα. Η φαρμακοκινητική του regorafenib δεν έχει μελετηθεί σε ασθενείς με σοβαρή νεφρική δυσλειτουργία ή νεφρική νόσο τελικού σταδίου. Ωστόσο, η βασισμένη στη φυσιολογία φαρμακοκινητική μοντελοποίηση δεν προβλέπει κάποια σημαντική μεταβολή στην έκθεση σε αυτούς τους ασθενείς. Στόχος του παρόντος περιστατικού να προτείνει αποτελεσματική και ταυτοχρόνως ασφαλή δόση του φαρμάκου.
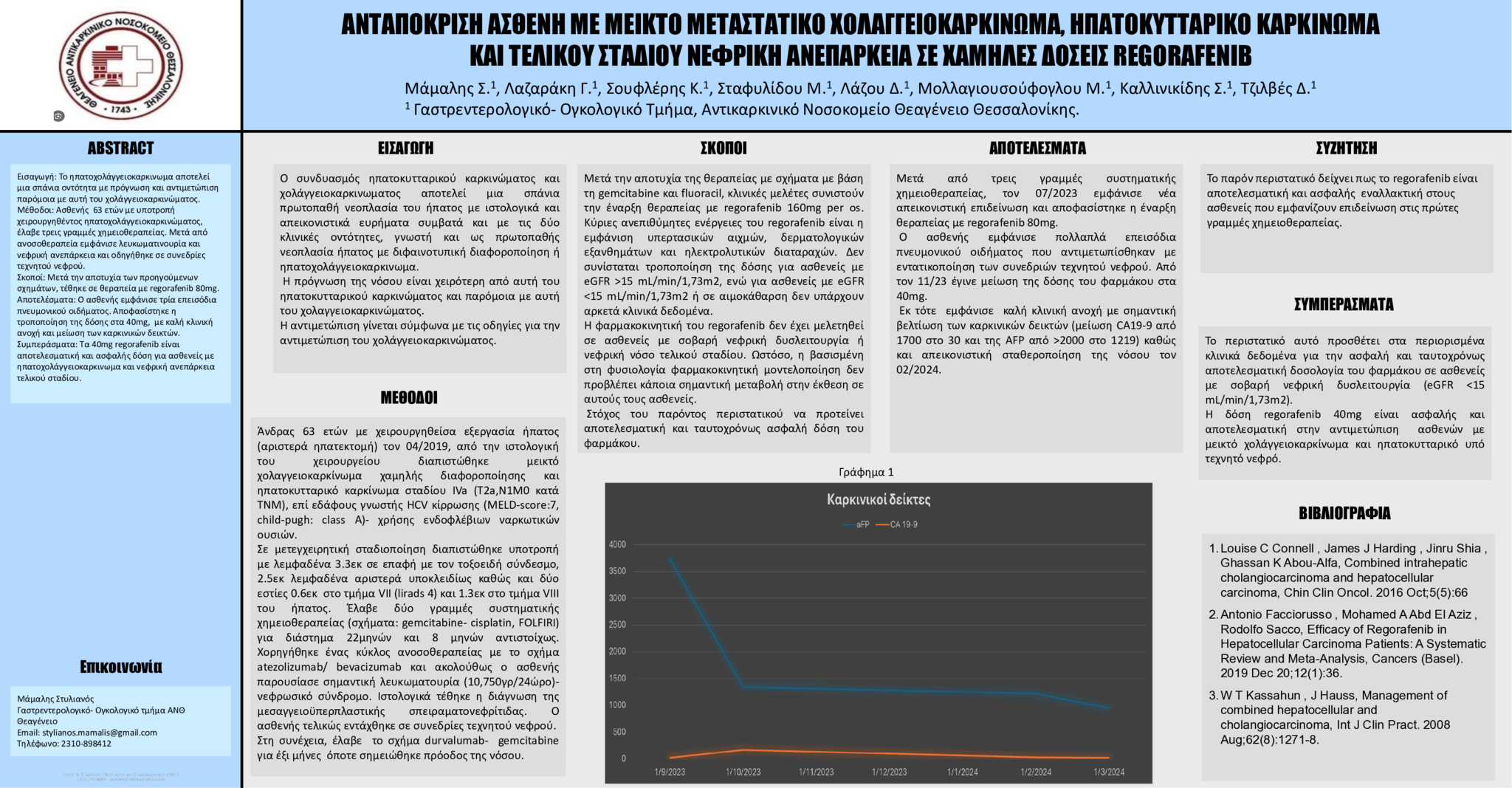
Αποτελέσματα: Μετά από τρεις γραμμές συστηματικής χημειοθεραπείας, τον 07/2023 εμφάνισε νέα απεικονιστική επιδείνωση και αποφασίστηκε η έναρξη θεραπείας με regorafenib 80mg. Ο ασθενής εμφάνισε πολλαπλά επεισόδια πνευμονικού οιδήματος που αντιμετωπίσθηκαν με εντατικοποίηση των συνεδριών τεχνητού νεφρού. Από τον 11/23 έγινε μείωση της δόσης του φαρμάκου στα 40mg. Εκ τότε εμφάνισε καλή κλινική ανοχή με σημαντική βελτίωση των καρκινικών δεικτών (μείωση CA19-9 από 1700 στο 30 και της AFP από >2000 στο 1219) καθώς και απεικονιστική σταθεροποίηση της νόσου τον 02/2024.
Συμπεράσματα: Το περιστατικό αυτό προσθέτει στα περιορισμένα κλινικά δεδομένα για την ασφαλή και ταυτοχρόνως αποτελεσματική δοσολογία του φαρμάκου σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (eGFR <15 mL/min/1,73m2). H δόση regorafenib 40mg είναι ασφαλής και αποτελεσματική στην αντιμετώπιση ασθενών με μεικτό χολάγγειοκαρκίνωμα και ηπατοκυτταρικό υπό τεχνητό νεφρό.
Abstract ID
EP47